Radioterapia
Czym jest radioterapia?
Radioterapia (RT) to leczenie promieniowaniem jonizującym (ma dostateczną energię, aby zjonizować materię). Odpowiednie planowanie radioterapii ma na celu dostarczenie możliwie jak największej dawki promieniowania do określonej objętości, w której znajdują się komórki nowotworowe przy maksymalnej ochronie tkanek zdrowych, które znajdują się wokół napromienionej objętości (które w przypadku braku ochrony mogłyby zostać uszkodzone). Promieniowanie jonizujące docierając do objętości napromienianej zostawia swoją energię np. poprzez tworzenie wolnych rodników we wnętrzu komórki. Zjawiska wywołane działaniem promieniowania powodują uszkodzenie DNA komórki nowotworowej, uniemożliwiając jej dalszy podział lub powodując jej śmierć.
Ze względu na umiejscowienie źródła promieniowania w stosunku do organizmu chorego, wyróżniamy dwie metody RT : teleradioterapię – źródło znajduje się poza nim oraz brachyterapię – źródło jest wprowadzane do jego wnętrza.[1]
Historia radioterapii
Historia leczenia radioterapią jest dosyć długa. Rozpoczęła się od odkrycia przez Wilhelma Roentgena promieniowania X. W kolejnych latach okazało się, że można to promieniowanie wykorzystać do leczenia. Pierwszy pacjent był leczony promieniowaniem rentgenowskim jeszcze w XIX wieku. Na przestrzeni ostatniego stulecia nastąpił ogromny postęp w tej dziedzinie medycyny. Odkrycia naukowe, rozwój technologii pozwala na stosowanie bezpiecznego leczenia na jak najwyższym poziomie. 4
Radioterapia kiedyś
Kiedyś uważano, że radioterapia służyć może nie tylko do leczenia chorób onkologicznych, ale również może działać przeciwbakteryjnie czy przeciwdrobnoustrojowo. Podczas podawania wiązek radioterapii nie było do końca wiadomo, na jakim obszarze, jak głęboko jest ona dostarczana. 4
Radioterapia dziś
Dzisiaj każda dawka radioterapii jest ściśle określona na każdy najmniejszy obszar. Obecnie wiemy coraz więcej o działaniu promieniowania na komórki organizmu, zarówno te zdrowe, jak i te zmienione nowotworowo. Wiemy coraz więcej o biologii komórek, o podziale tych komórek. Mamy coraz dokładniejszą diagnostykę – badania rezonansu czy TK pozwalają dokładnie zaplanować terapię. Pozwalają na to coraz dokładniejsze algorytmy fizyczne, które to obliczają, ale również nowoczesny sprzęt. 4
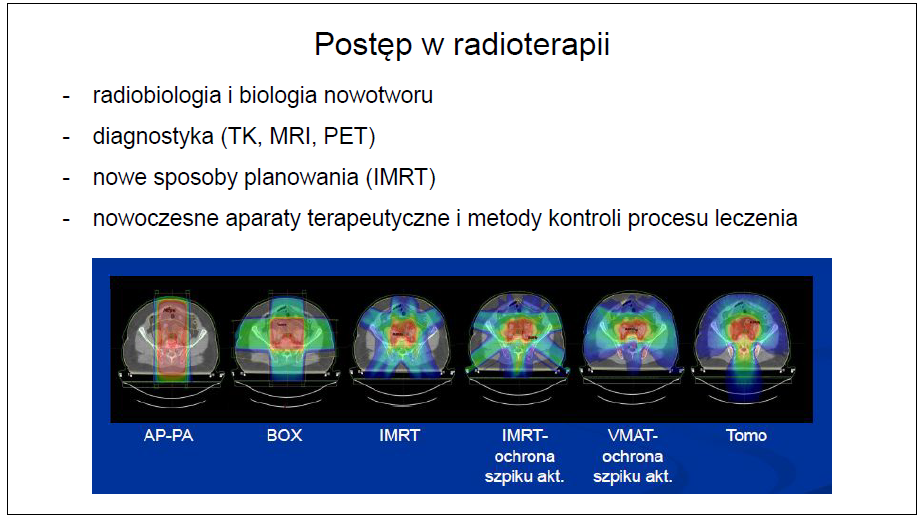
Źródło: Grafika pochodzi z wykładu lek. Agnieszki Thiem i lek. Alicji Czerwińskiej z Wielkopolskiego Centrum Onkologii,
Zimowa Akademia Dobrych Praktyk, Sieraków 2021
Dlaczego radioterapia szkodzi komórkom nowotworowym, a chroni te zdrowe?
Radioterapia szkodzi w znacznie większym stopniu komórkom nowotworowym, ponieważ zdrowe są zdecydowanie bardziej odporne na promieniowanie. Mają one sprawne mechanizmy naprawy i potrafią się zregenerować po napromienianiu. Drugim ważnym czynnikiem jest fakt, że radioterapia prowadzona jest tak precyzyjnie jak to tylko możliwe, z wykorzystaniem nowoczesnych technik planowania i dostarczania dawki, co pozwala na najlepszą ochroną tkanek zdrowych przy jednoczesnym dostarczeniem wysokiej dawki do docelowej objętości nowotworu. Ponadto leczenie promieniami jest przeprowadzane przez zespół ekspertów: techników radioterapii, fizyków medycznych i lekarzy onkologów-radioterapeutów. Te trzy zawody medyczne stanowią trzon radioterapii i każda z grup zawodowych ma bardzo duży wkład w dokładność leczenia i jego prawidłowy przebieg.
Cele radioterapii
1.Wyleczenie choroby nowotworowej. W wielu chorobach nowotworowych radioterapia jest skuteczną, bezkrwawą metoda leczenia z wysokim prawdopodobieństwem całkowitego wyleczenia np. rak prostaty, rak płuca, rak krtani. Pozwala uniknąć operacji i jej czasami przykrych skutków ubocznych np. rurki tracheostomijnej w przypadku raka krtani.
2. Zapobieganie nawrotom raka - jako uzupełnienie operacji np. leczenie oszczędzające piersi - dzięki radioterapii pooperacyjnej możemy usunąć tylko guza a nie całą pierś. Radioterapia niszczy komórki rakowe, które pozostały po operacji w leczonym narządzie.
3. Zatrzymanie lub zahamowanie wzrostu guza - jako radioterapia przedoperacyjna np. rak odbytnicy. Czasami na tyle zmniejsza
guz, że operacja, która na początku została wykluczona z uwagi na rozmiary guza, jest możliwa. 4
W jakich przypadkach stosowana jest radioterapia?
Szacuje się, że od 50% do 70% wszystkich pacjentów chorych na nowotwory złośliwe wymaga radioterapii na pewnym etapie swojego leczenia. Radioterapia pozostaje jedną z trzech najważniejszych metod leczenia pacjentów z chorobą nowotworową. Około 40% chorych, którzy przeżyli 5 lat od rozpoznania nowotworu złośliwego, swoje życie zawdzięcza właśnie tej metodzie[1]. Jeśli do 2035 roku, każdy chory, który potrzebuje radioterapii, będzie miał do niej dostęp, możliwe będzie uratowanie prawie miliona istnień każdego roku na świecie.[2]
Czterdzieści procent wszystkich nowotworów może zostać wyleczone z pomocą radioterapii, stosowanej jako samodzielne leczenie lub w połączeniu z chirurgią lub chemioterapią.
Radioterapia to metoda leczenia stosowana z powodzeniem w bardzo dużej ilości schorzeń onkologicznych oraz chorób nienowotworowych. Wiele nowotworów, jak np. oponiak – guz mózgu, rak gruczołu krokowego (prostaty) czy rak krtani może być skutecznie leczonych z wykorzystaniem samodzielnej radioterapii bez konieczności wykonywania zabiegu operacyjnego. U wielu chorych umożliwia to oszczędzenie narządu (np. krtani) lub uniknięcie ryzyka związanego z operacją (np. oponiaki). W wielu innych nowotworach skojarzenie radioterapii z chirurgią i chemioterapią umożliwia przeprowadzenie leczenia oszczędzającego (np. rak piersi lub mięsaki tkanek miękkich) lub przyczynia się do poprawy ogólnych wyników terapii.
Przebieg leczenia radioterapią
- Na pierwszej wizycie lekarz radioterapeuta zbiera wywiad od pacjenta, zapoznaje się z dokumentacją medyczną. Może również zlecić dodatkowe badania (np.np. badanie krwi, badanie laryngologiczne czy usg), aby ocenić stan zdrowia oraz pomogą ustalić plan leczenia.
- Po zakwalifikowaniu pacjenta do radioterapii oraz ewentualnych konsultacji, np. laryngologicznych, lekarz może przejść do planu leczenia.
- Wykonane jest specjalne unieruchomienie danej części ciała oraz przeprowadzenia badania tomografii komputerowej. Wtedy badanie jest wykonane w tej samej pozycji, w której pacjent będzie napromieniany podczas radioterapii. Nie jest to badanie diagnostyczne, które powie nam coś o ewentualnym postępie choroby, służy tylko do przygotowania planu leczenia.
- Lekarz onkolog radioterapeuta wyznacza parametry leczenia, ilość sesji, dawkę podaną każdego dnia, dawkę całkowitą, wyznaczane są miejsca, które chcemy napromieniać oraz te, które chcemy przed nim ochronić. Oprócz samego guza napromieniany jest też obszar wokół niego, w którym mogą znajdować się niewidoczne w badaniach pojedyncze komórki nowotworowe. W przypadku niektórych nowotworów napromieniane są również profilaktycznie węzły chłonne. Oprócz “celu” wyznaczane są również wrażliwe na promieniowanie narządy, które chcemy ochronić. Przygotowanie planu leczenia może zająć do dwóch tygodni. Aktualnie radioterapia jest całkowicie bezpieczna. Codziennie przeprowadzana jest kontrola jakości leczenia-przed seansem leczenia wykonywane sa różne formy obrazowania.
- Fizyk medyczny układa plan leczenia zgodnie z zaleceniami lekarza radioterapeuty.
- Gdy lekarz radioterapeuta zaakceptuje plan, kolejny fizyk sprawdza, czy aparat dostarczy promieniowanie we właściwe miejsce i we właściwej dawce.
- Sprawdzenie poprawności leczenia na symulatorze. Symulator wygląda jak aparat do naświetlania, nie dostarcza jednak promieniowania. Umożliwia sprawdzenie ułożenia pacjenta. Podczas symulacji na ciele narysowane zostają znaki - dzięki nim możliwa jest kontrola ułożenia przy każdej sesji. Znaków tych nie należy zmywać przez cały czas leczenia.
- Pierwsza sesja radioterapii – przy obecności lekarza prowadzącego. 4
Pierwsza sesja radioterapii
- Indywidualne przygotowanie. Nie dotyczy wszystkich pacjentów. W przypadku napromieniania niektórych okolic konieczne jest wypicie określonej ilości wody lub opróżnienie pęcherza moczowego, umożliwi to powtarzalność leczenia.
- Wejście do kabiny, odsłonięcie obszaru napromienianego. Kabina jest taka sama jak przed badaniem RTG czy TK, należy zdjąć ubrania zasłaniające naświetlany obszar.
- Przejście do pomieszczenia, w którym znajduje się aparat do radioterapii. Z pomocą technika, pacjent układa się na stole w określonej pozycji.
- Zamknięcie drzwi, obrazowanie i radioterapia. Urządzenie sterowane jest z zewnątrz pomieszczenia, dzięki kamerom obsługa ma podgląd na przebieg leczenia. Przed każdą sesją wykonuje się obrazowanie metodą niskodawkowego TK lub RTG, żeby upewnić się, że podajemy promieniowanie dokładnie w pożądane miejsce. Jeśli pacjent potrzebuje pomocy w trakcie naświetlania - źle się poczuje, podnosi rękę, co jest sygnałem dla obsługi, żeby przerwać emisję promieniowania. Bunkry wyposażone są również w mikrofon i głośniki i możliwa jest komunikacja głosowa. Sesja napromieniania trwa zazwyczaj kilka minut, jednak od przyjścia pod aparat jej do zakończenia upływa więcej czasu, ze względu na przygotowania (zdjęcie ubrać, ułożenie, obrazowanie). Niektórzy pacjenci czują się zaniepokojeni urządzeniem do naświetlania, zwłaszcza podczas pierwszych sesji. Urządzenie jest duże, niektórzy czują obawę przed przytrzaśnięciem lub uderzeniem głowicą - taka sytuacja nigdy się nie zdarzy. Aparaty przechodzą regularne przeglądy. Urządzenia podczas sesji mogą brzęczeć, hałasować, często obracają się wokół stołu terapeutycznego. Sesja trwa około 5-10 minut.
- Zakończenie sesji.4
Co umożliwiają nam nowoczesne techniki radioterapii?
Zazwyczaj mówiąc o teleradioterapii mamy na myśli terapię za pomocą przyspieszaczy (akceleratorów) liniowych z wykorzystaniem fotonów (cząsteczek światła). Na przestrzeni lat wraz z poprawą jakości leczenia radioterapią zwiększała się wyleczalność chorych. Nowoczesne przyspieszacze liniowe są wyposażone w szereg rozwiązań zwiększających bezpieczeństwo i precyzję radioterapii, takich jak kolimatory wielolistkowe oraz weryfikacja obrazowa na stole terapeutycznym. Zaawansowane technologicznie modyfikowane wersje przyspieszaczy liniowych otwierają nowe możliwości leczenia promieniami, takie jak precyzyjne napromienianie małych objętości z wykorzystaniem bardzo wysokich dawek promieniowania (CyberKnife) lub napromienianie dużych i ściśle zdefiniowanych objętości (tomoterapia). Szczególnym rodzajem teleradioterapii jest radioterapia cząsteczkowa, do której zaliczamy między innymi protonoterapię. Wymaga ona specjalnego sprzętu i znajduje zastosowanie głównie w sytuacjach, gdzie pożądane jest podwyższenie dawki w okolicy zdrowych tkanek szczególnie wrażliwych na promieniowanie (np. rdzenia kręgowego lub mózgu). Do leczenia większości chorób nowotworowych odpowiednią precyzję i jakość leczenia zapewniają nowoczesne techniki radioterapii fotonowej.
Przykładowe zaawansowane rozwiązania technologiczne we współczesnej radioterapii na podstawie CyberKnife:
-
Podążanie za ruchem pacjenta – synchronizacja z oddechem pacjenta: W przypadku standardowej radioterapii istnieje ryzyko, że pacjent lub docelowy narząd zmienią położenie. Zmiana położenia nawet o 1 milimetr może spowodować pogorszenie dalszych rokowań. Dzięki bardzo dużej swobodzie ruchu robota i bardzo dużej precyzji ruchu jako jedyny CyberKnife posiada funkcję synchronizowania się z oddechem pacjenta w czasie rzeczywistym. Wiązka napromieniania na bieżąco podąża za pozycją napromienianego guza. Pacjent w trakcie napromieniania może oddychać swobodnie i nie musi być w żaden sposób unieruchamiany ani nie musi wstrzymywać oddechu. Dokładność napromieniania jest zachowana (poniżej jednego milimetra) co przekłada się na brak konieczności stosowania dużych marginesów i mniejsze możliwe skutki uboczne napromieniania;
Źródło: materiały informacyjne na temat CyberKnife, Accuray
-
Precyzja leczenia: w innowacyjnej radioterapii robot porusza się z bardzo wysoką precyzją, mechaniczna precyzja robota to dziesiąte części milimetra (0,12 mm). W przypadku klasycznych akceleratorów precyzja mechaniczna to aż 2mm. Z tego względu konieczne jest stosowanie dużo większych marginesów, czyli musi zostać napromieniona dużo większa część tkanki, w tym tkanki zdrowej, co potencjalnie zwiększa skutki uboczne napromieniania;
Źródło: materiały informacyjne na temat CyberKnife, Accuray
- Skrócenie czasu leczenia: stereotaktyczna radioterapia ciała (SBRT) zwykle nie wymaga hospitalizacji i jest krótkotrwała – trwa około 1 tygodnia (5-7 frakcji) w porównaniu do terapii konwencjonalnej, która przeprowadzana jest zazwyczaj w czasie od 5 do 30 dni;
- Skutki uboczne: skutki uboczne terapii są zminimalizowane i mniejsze niż w przypadku napromieniania standardowymi akceleratorami.
Najczęstsze fakty i mity o radioterapii
Radioterapia jest trochę tajemniczą metoda leczenia, ponieważ w trakcie napromieniania chory nie odczuwa nic. Promieniowanie nie wydziela ciepła (a przynajmniej nie na odczuwalnym poziomie). Nie czuje się prądów. Całość procesu napromieniania przypomina wykonywanie zdjęcia rentgenowskiego czy tomografii komputerowejJednak pomimo tego, że radioterapia jest bezbolesna, na przestrzeni lat narosło wokół niej wiele mitów. Oto najpopularniejsze z nich:
Mity wokół radioterapii
- Radioterapia jest bolesna
Ludzkie ciało nie ma żadnego zmysłu, który mógłby odczuwać promieniowanie jonizujące. Jednak w skutek napromieniania skóra może zostać podrażniona czego konsekwencją może być ból skóry. Taki ból mija zazwyczaj krótko po zakończeniu leczenia.
- Radioterapia spowoduje, że będę radioaktywny/a?
Absolutnie nie. Promieniowanie, które przechodzi przez ciało nie jest później emitowane. Ta część promieniowania, która została pochłonięta przez ciało zamienia się w energię i w konsekwencji powoduje zmiany w komórkach napromienianych. Całość trwa ułamki sekund i odbywa się w zamkniętym bunkrze.
- Promieniowanie powoduje utratę włosów…
Promieniowanie może powodować utratę owłosienia, jednak tylko w miejscu, na które oddziaływała wiązka terapeutyczna. Pacjent nie traci włosów na głowie jeżeli ma napromienianą miednicę. W miejscu wejścia wiązki promieniowania może dochodzić do utraty włosów. W większości przypadków jest to jednak krótkotrwały efekt.
- Promieniowanie jest niebezpieczne
Każdy z nas słyszał o wypadku w Czarnobylu. Historia zna też kilka przypadków wypadków radiacyjnych, w których w sposób nieodpowiedni zostało napromienionych kilku pacjentów, powodując bardzo poważne skutki uboczne. Są to tak zwane błędy przeszłości, wynikające albo z niedostatku wiedzy, albo z braku wyobraźni. Oczywiście nigdy nie ma możliwości zapobieżenia wszystkim możliwym wypadkom, jednak rozwój technologii, dogłębna edukacja i lata badań spowodowały, że radioterapia jest nie tylko bezpieczniejsza niż latanie samolotem, ale także powoduje mniej skutków ubocznych niż chemioterapia czy chirurgia.
Działania niepożądane / odczyny popromienne
Lek. Bartłomiej Tomasik, absolwent Wydziału Lekarskiego Uniwersytetu Medycznego w Łodzi. Pracuje na Oddziale Radioterapii i Onkologii Ogólnej Wojewódzkiego Wielospecjalistycznego Centrum Onkologii i Traumatologii w Łodzi. Prowadzi także działalność naukową w Zakładzie Biostatystyki i Medycyny Translacyjnej Uniwersytetu Medycznego w Łodzi, gdzie zajmuje się analizą biomarkerów wczesnych i późnych odczynów popromiennych. [MS1] Działania niepożądane (odczyny) związane ze stosowaniem radioterapii są efektem oddziaływania promieniowania jonizującego na szybko dzielące się tkanki, do których należą m. in. skóra i błony śluzowe. W zależności od czasu wystąpienia objawów możemy wyróżnić tzw. ostre (wczesne) odczyny, które powstają w trakcie leczenia i do 3 miesięcy od zakończenia radioterapii, natomiast po tym czasie mówimy o tzw. późnych odczynach.
Historycznie, tolerancja skóry była głównym czynnikiem ograniczającym intensywność radioterapii. Obecnie, dzięki wspólnym wysiłkom radioterapeutów i fizyków medycznych, udało się częściowo przezwyciężyć ten problem, jednak nadal zdarza się, że odczyny skórne są powodem przerwy w leczeniu. Pierwszym krokiem wiodącym do poprawy sytuacji była modyfikacja frakcjonowania, tzn. podzielenie całkowitej dawki promieniowania na wiele mniejszych, często codziennych, dawek. Udowodniono, że powtarzalne małe dawki powodują mniej uszkodzeń niż pojedyncza frakcja o całkowitej takiej samej dawce. Inne czynniki związane z radioterapią i wpływające na intensywność odczynów to całkowity czas trwania leczenia oraz objętość poddawana napromienianiu – z tego powodu obecnie coraz częściej stosuje się schematy leczenia krótsze o kilka dni, a nawet tygodni w porównaniu do tych stosowanych kilkadziesiąt lat temu. Podobną sytuację obserwuje się w zakresie obszarów poddawanych radioterapii, mamy tu bowiem do czynienia z postępującym zmniejszaniem tych obszarów, co wynika z coraz lepszych technik obrazowania umożliwiających nam precyzyjną ocenę lokalizacji guza i jego stosunku do tkanek otaczających.
Bardzo ważnym aspektem jest także zastosowana technika radioterapii. Użycie nowoczesnych technik radioterapii jak np. radioterapia z modulowaną intensywnością wiązki (IMRT – intensity-modulated radiotherapy) zmniejsza ryzyko wystąpienia ciężkich odczynów skórnych. Należy jednak podkreślić, że w określonych sytuacjach klinicznych podanie większej dawki promieniowania na skórę jest pożądane. Dlatego zastosowanie bolusa (materiału nakładanego na obszar napromieniany, by dostosować dawkę deponowaną w głębi i na powierzchni skóry) lub zwiększanie dawki na określoną część obszaru napromienianego (boost) zwiększa ryzyko wystąpienia odczynów popromiennych, jest ono jednak uzasadnione, bowiem to postępowanie istotnie zwiększa szanse wyleczenia.
Wczesne odczyny skórne związane z napromienieniem nadal są bardzo powszechne, występują one u 80–100% pacjentów poddawanych radioterapii. Trzeba jednak podkreślić, że u większości chorych odczyny te mają łagodny charakter i tylko w niewielkim stopniu wpływają na jakość ich życia. Takie odczyny goją się stosunkowo szybko, nie pozostawiając trwałych śladów. Ostre skórne odczyny popromienne pojawiają się początkowo jako tzw. rumień przybierając odcień od lekko różowego do ciemnoczerwonego. Jeśli reakcja ulega nasileniu, pojawia się tak zwane „suche złuszczanie” objawiające się jako intensywne łuszczenie się skóry w okolicy napromienianej.
Niestety, część pacjentów, zwłaszcza tych poddawanych napromienianiu na obszar głowy i szyi czy miednicy, doświadcza cięższych reakcji. Odczyny te są związane z takimi objawami, jak ból, świąd i zakażenie, co w najgorszym wypadku prowadzi do przerw w leczeniu. Jak wspomniano, komórki naskórka są komórkami, które ulegają szybkim podziałom, jednak w czasie radioterapii, na skutek działania promieniowania jonizującego, produkcja nowych komórek ulega zmniejszeniu lub nawet całkowitemu zahamowaniu. W takiej sytuacji, komórki naskórka nadal ulegają złuszczeniu z powierzchni, ale jednocześnie w niższych warstwach nie powstają nowe. Prowadzi to do utraty naskórka i „odsłonięcia” głębszych warstw skóry, po czym dochodzi do tak zwanego mokrego złuszczenia. Po zakończeniu leczenia, w ciągu kilku tygodni, proces wzrostu i obrotu komórek powraca do normy i skóra może ulec wygojeniu, jednak do tego czasu stan ten wiąże się z dolegliwościami bólowymi, a także z podatnością na rozmaite infekcje. W przeszłości taki stan niejednokrotnie prowadził do martwicy skóry, jednak współcześnie, ze względu na opisany wcześniej postęp w radioterapii, a także rozwój leczenia wspomagającego, takie sytuacje są niezwykle rzadkie.
Należy zdecydowanie podkreślić, że wśród czynników wpływających na rozwój i nasilenie odczynów popromiennych bardzo dużą grupę stanowią czynniki ryzyka zależne od pacjenta. Wiele badań wykazało, że wysoka wartość wskaźnika masy ciała (BMI – body mass index) i palenie papierosów są czynnikami ryzyka wystąpienia ostrych skórnych odczynów popromiennych. Wiek chorego, typ skóry, uwarunkowania genetyczne, choroby współistniejące i spożywanie alkoholu również mogą być czynnikami ryzyka, jednak nie ma w tym względzie niezbitych dowodów.
Opublikowana w ostatnich latach analiza, obejmująca grupę ok. 400 kobiet leczonych z powodu raka piersi, wykazała, że wystąpienie ciężkich skórnych odczynów popromiennych związane było z całkowitą dawką promieniowania, wysoką wartością BMI, starszym wiekiem oraz paleniem papierosów. Co istotne, najsilniejszy związek z ciężkim odczynem popromiennym miały duża wartość BMI oraz palenie papierosów. W grupie kobiet palących, ryzyko wystąpienia ciężkich odczynów popromiennych było aż dwukrotnie większe niż u niepalących. Pacjentki z ciężkimi odczynami częściej zgłaszały silniejszy ból i problemy ze snem.
Radioterapia w zaawansowanej, nieuleczalnej chorobie nowotworowej:
- Przerzuty do kości – działanie przeciwbólowe
- Miejscowo zaawansowany rak płuca - zmniejszenie kaszlu, bólu w klatce piersiowej, krwioplucia oraz duszności
- Miejscowo zaawansowany rak przełyku i żołądka – zmniejszenie bólu przy przełykaniu, zmniejszenie krwawienia z żołądka
- Kompresja rdzenia kręgowego – poprawa czynności motorycznych, zmniejszenie bólu, odzyskanie funkcji zwieraczy
- Przerzuty do mózgu – zmniejszenie bólu głowy, utrzymanie funkcji poznawczych
- Nowotwory głowy i szyi – kontrola bólu, zmniejszenie dolegliwości związanych ze spożywaniem pokarmów stałych
- Rak pęcherza moczowego – zmniejszenie krwawienia, zmniejszenie częstości oddawania moczu, zmniejszenie bólu związanego z mikcją
- Rak odbytnicy – redukcja dolegliwości bólowych, kontrola krwawienia, poprawa funkcji zwieraczy
- Nowotwory żeńskich narządów rodnych – kontrola krwawienia oraz bólu
- Miejscowo zaawansowany rak prostaty – zmniejszenie bólu, krwawienia, obstrukcji dróg moczowych oraz objawów ze strony odbytnicy 4
[MS1]Dr n. med. B. Tomasik pracuje teraz w Gdańsku. Pewnie warto go zapytać a autoryzację.
1 Raport Krajowego Konsultanta w dziedzinie radioterapii onkologicznej na temat stanu radioterapii w Polsce na dzień 31.12.2019 r., http://kkro.io.gliwice.pl/wp-content/uploads/2020/05/Raport-na-temat-stanu-radioterapii-wPolsce -na-dzie%C5%84-31.12.2019.pdf
2 Raport PTO „Dostępność do świadczeń z zakresu radioterapii w województwie mazowieckim – analizy i prognozy”, 2015
